最全 口罩出口指南 看这篇就够了(4)
2023-03-16 来源:你乐谷
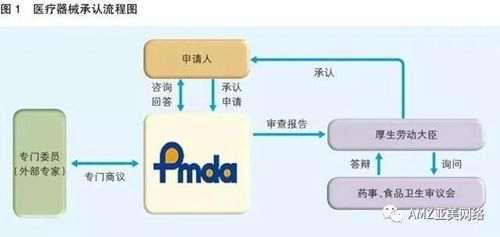
日本PMDA注册
1. 准备阶段。确定产品分类(I,II特殊控制,II类控制,III,IV)和产品JMDN编码,选择MAH(日本持证方);2. 制造商向PMDA注册工厂;3. II类特殊控制产品向授权认证机构PCB申请QMS工厂审核,其他II类产品和III类IV类产品向PMDA申请QMS工厂审核,并获得QMS证书;4. 申请Pre-Market Apporval证书,II类特殊控制由PCB发证,其他II类产品和III类IV类产品控制由MHLW(厚生劳动省)发证;5. 支付申请费用;6. 注册文件整改,注册批准;7. 所有类别产品均需要MAH向RBHW(厚生省地区机构)进行进口通报注册后才能进口销售。
韩国KFDA注册
韩国卫生福利部(MinistryofHealthandWelfare,MHW),简称卫生部,主要负责管食品、药品、化妆品和医疗器械的办理,是最主要的卫生保健部门。依照《医疗器械法》,韩国卫生福利部下属的食品药品安全部负责对医疗器械的监管工作。KFDA注册流程为:1. 确定产品分类(I,II,III,IV),选择KLH(韩国持证方);2. II类产品需申请KGMP证书和接受现场审核,II类产品一般是授权的第三方审核员,并获得KGMP证书;3. II类产品需要送样品到韩国MFDS授权的实验室进行韩国标准的测试;4. 由KLH向MFDS(韩国食品药品安全部)提交技术文件(检测报告,KGMP证书等),进行注册审批;5. 支付申请费用;6. 注册文件整改,注册批准;7. 指定韩国代理商和经销商,产品销售。
澳大利亚TGA注册
依据Australian Therapeutic Goods (Medical Devices) Regulations 2002,澳大利亚对医疗器械分为I类,Is and Im, IIa, IIb, III类,产品的分类几乎和欧盟分类一致,如产品已获得CE标识标记标帜,则产品类别可以按照CE分类。值得注意的是,如已经获得欧盟公告机构(Notified Body)签发的CE证书,是可以被TGA认可的,并可以作为满足澳大利亚安全法规的重要注册资料。
1. 准备阶段。确定产品分类(I,II特殊控制,II类控制,III,IV)和产品JMDN编码,选择MAH(日本持证方);2. 制造商向PMDA注册工厂;3. II类特殊控制产品向授权认证机构PCB申请QMS工厂审核,其他II类产品和III类IV类产品向PMDA申请QMS工厂审核,并获得QMS证书;4. 申请Pre-Market Apporval证书,II类特殊控制由PCB发证,其他II类产品和III类IV类产品控制由MHLW(厚生劳动省)发证;5. 支付申请费用;6. 注册文件整改,注册批准;7. 所有类别产品均需要MAH向RBHW(厚生省地区机构)进行进口通报注册后才能进口销售。
韩国KFDA注册
韩国卫生福利部(MinistryofHealthandWelfare,MHW),简称卫生部,主要负责管食品、药品、化妆品和医疗器械的办理,是最主要的卫生保健部门。依照《医疗器械法》,韩国卫生福利部下属的食品药品安全部负责对医疗器械的监管工作。KFDA注册流程为:1. 确定产品分类(I,II,III,IV),选择KLH(韩国持证方);2. II类产品需申请KGMP证书和接受现场审核,II类产品一般是授权的第三方审核员,并获得KGMP证书;3. II类产品需要送样品到韩国MFDS授权的实验室进行韩国标准的测试;4. 由KLH向MFDS(韩国食品药品安全部)提交技术文件(检测报告,KGMP证书等),进行注册审批;5. 支付申请费用;6. 注册文件整改,注册批准;7. 指定韩国代理商和经销商,产品销售。
澳大利亚TGA注册
依据Australian Therapeutic Goods (Medical Devices) Regulations 2002,澳大利亚对医疗器械分为I类,Is and Im, IIa, IIb, III类,产品的分类几乎和欧盟分类一致,如产品已获得CE标识标记标帜,则产品类别可以按照CE分类。值得注意的是,如已经获得欧盟公告机构(Notified Body)签发的CE证书,是可以被TGA认可的,并可以作为满足澳大利亚安全法规的重要注册资料。

 排泄物を食べる黄金指南卜亻
排泄物を食べる黄金指南卜亻










