最全 口罩出口指南 看这篇就够了(3)
2023-03-16 来源:你乐谷
澳大利亚
必要资料:提单,箱单,发票准入门槛:须通过澳洲的TGA(治疗商品办理局)注册,符合标准规范:AS/NZS 1716:2012,此规范是澳大利亚和新西兰的呼吸庇护装置标准。TGA(治疗商品办理局)是澳大利亚的治疗商品(包括药物、医疗器械、基因科技和血液制品)的监督机构。口罩要求:AS/NZS 1716:2012是澳大利亚和新西兰的呼吸庇护装置标准,相关产品制造流程和测试必需符合本规范。
各国注册、认证简要办理流程
美国NIOSH认证
需按照NIOSH的指南实施,企业需寄送样品至NIOSH实验室实施测试,同时提交技术性资料(包罗质量体系部分资料)至NIOSH文审,只有文审和测试都通过,NIOSH才核发批文。主要测试指标包括呼气阻力测试、呼气阀泄漏测试、吸气阻力测试、过滤效率测试。
美国FDA注册
值得注意的是,对Ⅰ类产品,企业向FDA递交相关资料后,FDA只进行公告,并无相关证件发给企业。对Ⅱ、Ⅲ类器械,企业须递交PMN或PMA,FDA在公告的同时,会给企业以正式的市场准入批准函件(Clearance),即允许企业以本身的名义在美国医疗器械市场上直接销售其产品。
欧盟CE注册CE认证流程:① 认证申请——企业提供产品的技术资料,认证机构按照资料确定适用指令和标准;① 签署合同——企业和认证机构签署CE标识表及标识认证合同;② 产品预检——认证机构将样品送至授权的相关实验室测试;③ 产品终检——企业对产品进行调整,补齐相关手续,实验室给出最终检测报告;④ 企业整改——企业按照终检报告进行整改;⑤ 技术评审——实验室对产品进行技术评审;⑧ 证书签发——产品评审合格,由欧盟授权的公告机构给产品签发证书。
必要资料:提单,箱单,发票准入门槛:须通过澳洲的TGA(治疗商品办理局)注册,符合标准规范:AS/NZS 1716:2012,此规范是澳大利亚和新西兰的呼吸庇护装置标准。TGA(治疗商品办理局)是澳大利亚的治疗商品(包括药物、医疗器械、基因科技和血液制品)的监督机构。口罩要求:AS/NZS 1716:2012是澳大利亚和新西兰的呼吸庇护装置标准,相关产品制造流程和测试必需符合本规范。
各国注册、认证简要办理流程
美国NIOSH认证
需按照NIOSH的指南实施,企业需寄送样品至NIOSH实验室实施测试,同时提交技术性资料(包罗质量体系部分资料)至NIOSH文审,只有文审和测试都通过,NIOSH才核发批文。主要测试指标包括呼气阻力测试、呼气阀泄漏测试、吸气阻力测试、过滤效率测试。
美国FDA注册
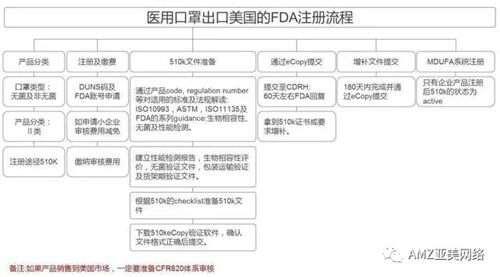
值得注意的是,对Ⅰ类产品,企业向FDA递交相关资料后,FDA只进行公告,并无相关证件发给企业。对Ⅱ、Ⅲ类器械,企业须递交PMN或PMA,FDA在公告的同时,会给企业以正式的市场准入批准函件(Clearance),即允许企业以本身的名义在美国医疗器械市场上直接销售其产品。
欧盟CE注册CE认证流程:① 认证申请——企业提供产品的技术资料,认证机构按照资料确定适用指令和标准;① 签署合同——企业和认证机构签署CE标识表及标识认证合同;② 产品预检——认证机构将样品送至授权的相关实验室测试;③ 产品终检——企业对产品进行调整,补齐相关手续,实验室给出最终检测报告;④ 企业整改——企业按照终检报告进行整改;⑤ 技术评审——实验室对产品进行技术评审;⑧ 证书签发——产品评审合格,由欧盟授权的公告机构给产品签发证书。

 排泄物を食べる黄金指南卜亻
排泄物を食べる黄金指南卜亻










