长生生物问题疫苗批次是多少?武汉生物百白破疫苗有问题的批号介绍(2)
2023-03-13 来源:你乐谷
武汉生物制品研究所有限责任公司生产上述不合格批次疫苗共计400520支,全部销往了河北省和重庆市,其中销往重庆市疾病预防控制中心190520支,销往河北省疾病预防控制中心210000支。
为保证接种过不合格百白破疫苗的儿童免于发病,山东省使用合格的百白破疫苗按照国家免疫程序规定,开展后续剂次百白破疫苗的常规接种。从那时起,截至目前,全省215184名接种不合格百白破疫苗儿童中,已有208579人(占总人数的96.93%)使用其它企业生产的合格百白破疫苗,完成后续相应剂次的常规接种。其他6605名儿童将根据接种间隔时间要求等相关情况,陆续开展接种。
人民网武汉7月22日电 近日,长春长生企业一批次狂犬疫苗出了问题,紧接着又爆出长春长生及武汉生物的2个批次的百白破疫苗不符合标准规定。
据原国家食品药品监管总局官网2017年11月3日发布的信息显示,除了长春长生,武汉生物制品研究所有限责任公司生产的批号为201607050-2的百白破疫苗效价指标也不符合标准规定。武汉生物制品研究所有限责任公司生产上述不合格批次疫苗共计400520支,销往重庆市疾病预防控制中心190520支,销往河北省疾病预防控制中心210000支。
据武汉市食品药品监督管理局官网今年6月行政处罚信息公开显示,武汉生物制品研究所有限责任公司生产的吸附无细胞百白破联合疫苗(批号:201607050-2,规格:0.5ml),经检验,其[效价测定]项不符合标准规定、被判定为不合格。违反了《中华人民共和国药品管理法》第四十九条第一款、第三款第(六)项的规定,依据《中华人民共和国药品管理法》第七十四条,《中华人民共和国行政处罚法》第二十七条第一款第(一)项的规定。5月29日,武汉市食品药品监督管理局以生产销售
劣药对该公司进行了行政处罚,处以没收违法所得、罚款。行政处罚决定书文号为(武)食药监食罚〔2018〕01-24005号。
武汉生物制品研究所有限责任公司隶属于国务院国资委主管的中国医药集团总公司下属的中国生物技术
股份有限公司,拥有年产7500万剂量吸附无细胞百白破联合疫苗生产基地,每年生产30多个品种及100多个规格近2亿剂量的产品。产品销售达30个省市自治区,3个产品出口埃及和东南亚等国家。
另据中国裁判文书网显示,2014年许某在黄州区人民医院预防接种武汉生物公司生产的百白破疫苗以及口服了北京天坛公司生产的脊灰疫苗后,身体出现异常情况。湖北省黄冈市预防接种异常反应
调查诊断专家组作出《调查诊断书》认定:“本病例不排除预防接种异常反应。现有的技术不能确定幼儿的损害与使用武汉生物公司、北京天坛公司生产的药品有因果关系”。
为保证接种过不合格百白破疫苗的儿童免于发病,山东省使用合格的百白破疫苗按照国家免疫程序规定,开展后续剂次百白破疫苗的常规接种。从那时起,截至目前,全省215184名接种不合格百白破疫苗儿童中,已有208579人(占总人数的96.93%)使用其它企业生产的合格百白破疫苗,完成后续相应剂次的常规接种。其他6605名儿童将根据接种间隔时间要求等相关情况,陆续开展接种。
人民网武汉7月22日电 近日,长春长生企业一批次狂犬疫苗出了问题,紧接着又爆出长春长生及武汉生物的2个批次的百白破疫苗不符合标准规定。
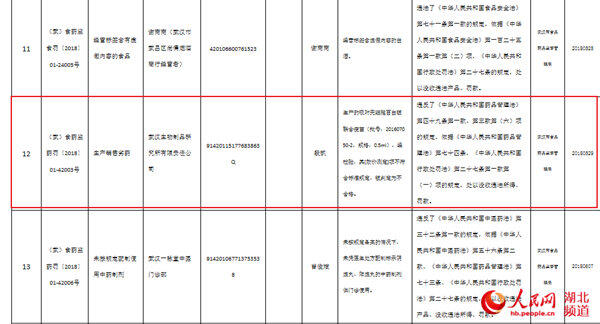
据原国家食品药品监管总局官网2017年11月3日发布的信息显示,除了长春长生,武汉生物制品研究所有限责任公司生产的批号为201607050-2的百白破疫苗效价指标也不符合标准规定。武汉生物制品研究所有限责任公司生产上述不合格批次疫苗共计400520支,销往重庆市疾病预防控制中心190520支,销往河北省疾病预防控制中心210000支。
据武汉市食品药品监督管理局官网今年6月行政处罚信息公开显示,武汉生物制品研究所有限责任公司生产的吸附无细胞百白破联合疫苗(批号:201607050-2,规格:0.5ml),经检验,其[效价测定]项不符合标准规定、被判定为不合格。违反了《中华人民共和国药品管理法》第四十九条第一款、第三款第(六)项的规定,依据《中华人民共和国药品管理法》第七十四条,《中华人民共和国行政处罚法》第二十七条第一款第(一)项的规定。5月29日,武汉市食品药品监督管理局以生产销售
劣药对该公司进行了行政处罚,处以没收违法所得、罚款。行政处罚决定书文号为(武)食药监食罚〔2018〕01-24005号。
武汉生物制品研究所有限责任公司隶属于国务院国资委主管的中国医药集团总公司下属的中国生物技术
股份有限公司,拥有年产7500万剂量吸附无细胞百白破联合疫苗生产基地,每年生产30多个品种及100多个规格近2亿剂量的产品。产品销售达30个省市自治区,3个产品出口埃及和东南亚等国家。
另据中国裁判文书网显示,2014年许某在黄州区人民医院预防接种武汉生物公司生产的百白破疫苗以及口服了北京天坛公司生产的脊灰疫苗后,身体出现异常情况。湖北省黄冈市预防接种异常反应
调查诊断专家组作出《调查诊断书》认定:“本病例不排除预防接种异常反应。现有的技术不能确定幼儿的损害与使用武汉生物公司、北京天坛公司生产的药品有因果关系”。

 贫乳学生无码番号
贫乳学生无码番号












